Профориентационное образовательное мероприятие "Горизонты Образования" в образовательных учреждениях города Иркутск.
Профориентационное образовательное мероприятие "Горизонты Образования" в образовательных учреждениях города Владивосток
Профориентационное образовательное мероприятие "Горизонты Образования" в образовательных учреждениях города Хабаровск
Профориентационное образовательное мероприятие "Горизонты Образования" в образовательных учреждениях города Саратов
Профориентационное образовательное мероприятие "Горизонты Образования" в образовательных учреждениях города Самара
Профориентационное образовательное мероприятие "Горизонты Образования" в образовательных учреждениях города Казань
Колледж электроники и приборостроения
Санкт-Петербургский горный университет, СПГУ
Справочник
Химические свойства карбоновых кислот
Карбоновые кислоты проявляют высокую реакционную способность и вступают в реакции с различными веществами, образуя разнообразные соединения, среди которых большое значение имеют функциональные производные: сложные эфиры, амиды, нитрилы, соли, ангидриды, гало-генангидриды.
1. а) 2CH3COOH + Fe > (CH3COO)2Fe + Н2 (образование солей)
б) 2CH3COOH + MgO > (CH3COO)2Mg + Н2O
в) CH3COOH + KOH > CH3COОК + Н2O
г) CH3COOH + NaHCO3 > CH3COONa + CO2 + Н2O
CH3COONa + H2O - CH3COOH + NaOH (соли карбоновых кислот гидролизуются)
2. (образование вложных эфиров)
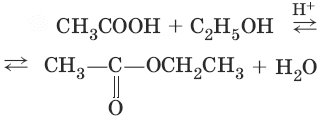
(омыление вложного эфира)
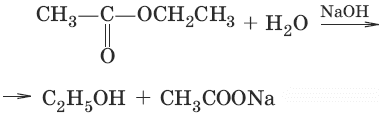
3. (получение хлорангидридов кислот)
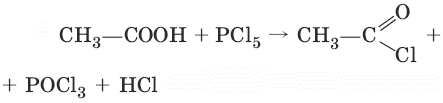
4. (разложение водой)
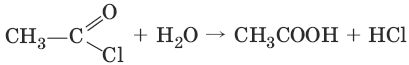
5. CH3—COOH + Cl2 >hv> Cl—CH2—COOH + HCl (галогенирование в ?-положение)
6. HO—CH=O + Ag2O >NH3> 2Ag + Н2CO3 (Н2O + CO2) (особенности HCOOH)
HCOOH >t> CO + Н2O










